اکسیداسیون به معنای به دست آوردن اکسیژن در یک واکنش شیمیایی است. اکسیداسیون و احیا را از دو دیدگاه متفاوت بررسی خواهیم کرد.
واکنش های شیمیایی که شامل انتقال الکترون از یک ماده شیمیایی به ماده دیگر است. این واکنشهای انتقال الکترون را واکنشهای احیا اکسیداسیون یا واکنشهای ردوکس مینامند. این واکنش ها با تغییرات انرژی به شکل گرما، نور و الکتریسیته و غیره همراه است. واکنش اکسیداسیون و احیا نیز شامل افزودن اکسیژن یا هیدروژن به مواد مختلف است.
اگر برای تولید کارخانه خود به خرید مواد شیمیایی نیاز دارید میتوانید به ما مراجعه کنید.
اکسیداسیون چیست؟
طبق مفهوم کلاسیک یا قبلی، اکسیداسیون فرآیندی است که شامل افزودن اکسیژن یا هر عنصر الکترونگاتیو یا حذف هیدروژن یا هر عنصر الکترومثبت است.
طبق مفهوم الکترونیکی اکسیداسیون به فرآیندی گفته می شود که در آن یک اتم یا یون یک یا چند الکترون را از دست می دهد.
احیا چیست؟
بر اساس مفهوم کلاسیک یا قبلی، احیا فرآیندی است که شامل افزودن هیدروژن یا هر عنصر الکترومثبت یا حذف اکسیژن یا هر عنصر الکترونگاتیو است.
طبق مفهوم الکترونیکی، احیا به فرآیندی گفته می شود که در آن یک اتم یا یون یک یا چند الکترون به دست می آورد.
ایده کلاسیک واکنش های اکسیداسیون و احیا:
واکنش های اکسیداسیون شامل:
-
افزودن اکسیژن:
C + O2 → CO2 (اکسیداسیون کربن)
-
افزودن عنصر الکترونگاتیو:
Fe + S → FeS (اکسیداسیون آهن)
-
حذف هیدروژن:
H2S + Br2 → 2 HBr + S (اکسیداسیون سولفید)
-
حذف عناصر الکتروپوزیتیو:
KI + H2O2 → I2 + 2 KOH (اکسیداسیون یدید)
عامل اکسید کننده ماده ای است که باعث اکسیداسیون می شود. در مثال های بالا O2، S، Cl2، Br2، و H2O2 عوامل اکسید کننده هستند.
واکنش های احیای شامل:
-
افزودن هیدروژن:
N2 + 3 H2 → 2NH3 (احیا نیتروژن)
-
افزودن عنصر الکتروپوزیتیو:
SnCl2 + 2HgCl2 → SnCl4 + Hg2Cl2 (احیا کلرید جیوه)
-
حذف اکسیژن
ZnO + C → Zn + CO (احیا اکسید روی)
-
حذف عنصر الکترونگاتیو
FeCl3 + H2 → 2FeCl2 + 2HCl (احیا کلرید آهن)
عامل کاهنده ماده ای است که باعث احیا می شود. در مثال های بالا H2، HgCl2 و C عوامل کاهنده هستند.
نکته:
ماده ای که تحت اکسیداسیون قرار می گیرد به عنوان یک عامل کاهنده عمل می کند در حالی که ماده ای که تحت احیا قرار می گیرد به عنوان یک عامل اکسید کننده عمل می کند.
اکسیداسیون و احیا از نظر انتقال الکترون
- این رایج ترین تعریفی است که از اکسیداسیون و احیا استفاده می شود و بیشترین کاربرد را دارد.
- در این حالت، اکسیداسیون از دست دادن الکترون ها و احیا، افزایش الکترون ها است.
واکنش های اکسیداسیون و احیا همیشه به هم مرتبط هستند. از آنجایی که الکترون ها در یک واکنش شیمیایی نه ایجاد می شوند و نه از بین می روند، اکسیداسیون و احیا همیشه به صورت جفت اتفاق می افتد، وجود یکی بدون دیگری غیرممکن است. در واکنش زیر منیزیم با از دست دادن دو الکترون به اکسیژن اکسید می شود که با پذیرش دو الکترون از منیزیم احیا می یابد.
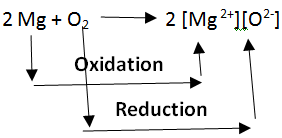
از آنجایی که اکسیداسیون و احیا نمی توانند به صورت جداگانه اتفاق بیفتند، به طور کلی به آنها “واکنش های ردوکس” می گویند. واکنش دهنده ای که واکنش دهنده های دیگر را اکسید می کند، عامل اکسید کننده و واکنش دهنده ای که احیا می دهد، عامل کاهنده نامیده می شود. در مورد این که آیا عوامل اکسید کننده الکترون ها را می پذیرند یا می بخشند، سردرگمی وجود دارد.
مراحل زیر می تواند به شما در درک آن کمک کند.
- یک عامل اکسید کننده سایر واکنش دهنده ها را اکسید می کند
- این باید به این معنی باشد که عامل اکسید کننده در حال احیا است
- اکسیداسیون از دست دادن الکترون است (OIL RIG)
- بنابراین یک عامل اکسید کننده باید الکترون به دستآورد
واکنش های متداول ردوکس
سه واکنش متداول ردوکس در زیر مورد بحث قرار گرفته است:
- واکنش احتراق – این یک نوع واکنش ردوکس است که بین اکسیژن مولکولی و ترکیب رخ می دهد و محصولات حاوی اکسیژن را تشکیل می دهد.
2C8H18+25O2 → 16CO2(g)+18H2O
- واکنش عدم تناسب – این یک نوع واکنش ردوکس است که در آن یک واکنش دهنده واحد احیا یافته و اکسید می شود. همچنین به عنوان یک واکنش اکسیداسیون خودکار شناخته می شود.
3ClO−(aq) → ClO3−(aq)+2Cl−(aq)
- واکنش جایگزینی منفرد – این یک نوع واکنش ردوکس است که شامل جابجایی دو عنصر در یک ترکیب است. همچنین به عنوان واکنش تک جابجایی شناخته می شود.
Zn(s)+2HCl(aq) → ZnCl2(aq)+H2(g)
چگونه واکنش ردوکس را متعادل کنیم؟
هر واکنش شیمیایی باید بر اساس “قانون بقای جرم” متعادل شود. معادلات شیمیایی که شامل اکسیداسیون و احیا می شوند را نیز می توان با کمک روش های زیر متعادل کرد
- روش عددی اکسیداسیون
- روش الکترونی یونی (یا روش نیمه واکنش)
درباره یون ها و ترکیبات یونی اینجا بیشتر بخوانید.
روش عدد اکسیداسیون:
مراحل مختلف درگیر در متعادل کردن یک معادله ردوکس با روش اکسیداسیون در اینجا از طریق یک مثال مورد بحث قرار می گیرد.
مثال:
معادله شیمیایی را با روش عددی اکسیداسیون متعادل کنید
CuO + NH3 → Cu + N2 + H2O
راه حل:
مرحله 1: عدد اکسایش هر اتم را در معادله اسکلت بنویسید
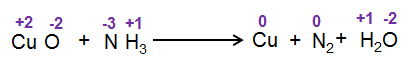
مرحله 2: اتم هایی را که در عدد اکسیداسیون تغییر می کنند، شناسایی کنید.
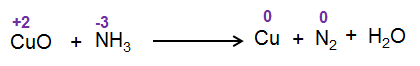
مرحله 3 : افزایش و احیا عدد اکسیداسیون w.r.t اتم های واکنش دهنده را محاسبه کنید.
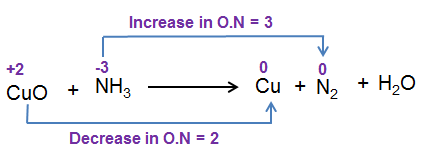
مرحله 4: افزایش و احیا عدد اکسیداسیون در سمت واکنش دهنده را برابر کنید.
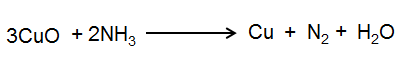
مرحله 5: تعداد اتم های مس و N را در دو طرف معادله متعادل کنید.
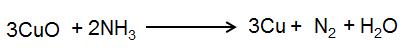
مرحله 6: اکنون اتم های H و O را با روش ضربه و آزمایش متعادل کنید.
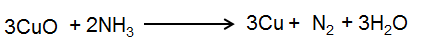
نکته 1: در واکنشهایی که در محیط اسیدی انجام میشود، اتم O را با اضافه کردن تعداد مورد نیاز مولکول H2O به سمتی که دارای اتمهای O است، متعادل کنید. سپس اتم های H را با اضافه کردن H+ به سمتی که دارای اتم H است متعادل کنید.
نکته 2: در محیط پایه، ابتدا تعداد بارهای منفی را با اضافه کردن تعداد مورد نیاز یون OH- به طرف دارای کمبود در مقدار بارها متعادل کنید. سپس مولکول های H2O را در طرف دیگر اضافه کنید تا یون های OH- اضافه شده را متعادل کنید.
روش الکترونی یونی (یا روش نیمه واکنش):
بر اساس این اصل است که الکترون های از دست رفته در طی واکنش نیمه اکسیداسیون در یک واکنش ردوکس خاص برابر با الکترون های بدست آمده در واکنش نیمه احیای است. این شیوه، روش نیمه واکنش نامیده می شود. تعادل در مراحل زیر تکمیل می شود:
مثال:
معادله شیمیایی را با روش یون الکترون متعادل کنید:
Cr2O72- + Fe2+ + H+ → Cr3+ + Fe3+ + H2O
مرحله 1: عدد اکسایش هر اتم را در معادله اسکلت بنویسید:
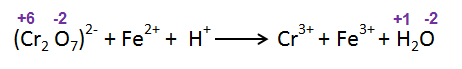
مرحله 2: گونه های دخیل در واکنش های نیمه اکسیداسیون و احیا را بیابید:
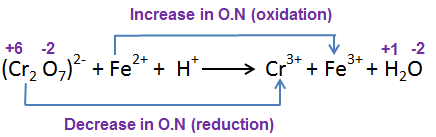
مرحله 3: نیمه واکنش اکسیداسیون متعادل:
با افزایش عدد اکسیداسیون 1، یک e– در سمت محصول اضافه کنید تا تغییر در O.N متعادل شود.
![]()
مرحله 4: نیمه واکنش احیا متعادل:
احیا عدد اکسیداسیون در هر اتم کروم 3 و احیا کل O.N برای دو اتم کروم 6 است. بنابراین، 6e– را در سمت واکنش دهنده اضافه کنید. برای متعادل کردن اتمهای O، 7 مولکول H2O را در سمت محصول اضافه کنید سپس اتمهای H را با اضافه کردن 14 H+ در سمت واکنشدهنده متعادل کنید.
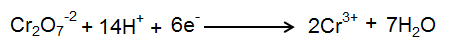
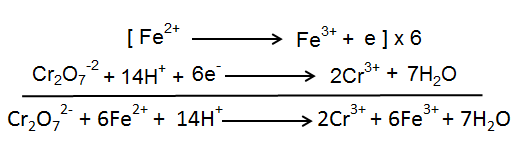
مرحله 5: اضافه کردن دو نیمه واکنش:
اکسیداسیون در مقابل احیا
هنگامی که یک واکنش دهنده در طی یک واکنش الکترون های خود را از دست می دهد، اکسیداسیون نامیده می شود. هنگامی که یک واکنش دهنده در طی یک واکنش الکترون ها را جمع می کند، به آن احیا می گویند. هنگامی که فلزات با اسید واکنش می دهند، این یک اتفاق رایج است. هنگامی که یک واکنش دهنده در طی یک واکنش الکترون های خود را از دست می دهد، اکسیداسیون نامیده می شود. هنگامی که یک واکنش دهنده در طی یک واکنش الکترون ها را جمع می کند، به آن احیا می گویند. هنگامی که فلزات با اسید واکنش می دهند، این یک اتفاق رایج است.
واکنش احیا-اکسیداسیون یا واکنش ردوکس نوعی واکنش شیمیایی است که در آن احیا و اکسیداسیون همزمان اتفاق میافتد. گونه های احیا شده الکترون ها را دریافت می کنند در حالی که گونه های اکسید شده آنها را از دست می دهند. یک فرآیند اکسیداسیون علیرغم نامش نیازی به حضور اکسیژن ندارد.
خلاصه
در اصل، اصطلاح اکسیداسیون برای توصیف واکنش هایی استفاده می شد که در آن یک عنصر با اکسیژن ترکیب می شود. به عنوان مثال، اکسیداسیون منیزیم شامل واکنش شیمیایی بین فلز منیزیم و اکسیژن برای تشکیل اکسید منیزیم است.
کلمه احیا از معنای “به عقب بردن” ریشه لاتین می آید. بنابراین، هر چیزی که در واکنش شیمیایی که قبلاً ذکر شد، به فلز منیزیم باز می گردد، دلالت بر احیا دارد. نمونه ای از احیای اکسید منیزیم به فلز منیزیم، واکنش بین اکسید منیزیم و کربن در دمای 2000 درجه سانتیگراد برای تشکیل فلز منیزیم و مونوکسید کربن است.
با توجه به تغییرات در حالت های اکسیداسیون که بدون انتقال مستقل الکترون ها رخ می دهد، بسیاری از واکنش ها در شیمی آلی را می توان به عنوان واکنش های ردوکس طبقهبندی کرد. به عنوان مثال، حالت اکسیداسیون اتم های کربن در چوب در طی احتراق چوب با اکسیژن مولکولی افزایش می یابد و با تولید دی اکسید کربن و آب، حالت اتم های اکسیژن احیا می یابد. اتمهای اکسیژن احیا مییابند و به طور رسمی الکترونها را دریافت میکنند، در حالی که اتمهای کربن اکسید میشوند و الکترونها را از دست میدهند. بنابراین اکسیژن عامل اکسید کننده و عامل احیا کننده در این واکنش کربن است.
سوالات متداول
تفاوت بین اکسیداسیون و احیا چیست؟
اگر ماده ای اکسید شود، در یک واکنش در شیمی الکترون ها را از دست می دهد. اگر ماده ای احیا یابد در یک واکنش الکترون به دست می آورد. واکنشی که در آن هم اکسیداسیون و هم احیا وجود دارد، واکنش REDOX نامیده می شود.
چرا اکسیداسیون و احیا مهم هستند؟
واکنشهای احیا اکسیداسیون اهمیت زیادی دارند زیرا آنها منابع اصلی انرژی طبیعی یا بیولوژیکی و مصنوعی در این سیاره هستند. اکسیداسیون مولکول ها معمولاً با حذف هیدروژن و جایگزینی آن با اکسیژن، مقدار زیادی انرژی آزاد می کند.
فرآیند احیا اکسیداسیون چیست؟
ماده ای را که الکترون می دهد اکسید می کند. هنگامی که آهن با اکسیژن واکنش می دهد، یک ماده شیمیایی به نام زنگ ایجاد می کند، زیرا اکسید شده (آهن مقداری الکترون از دست داده است) و اکسیژن احیا یافته است (اکسیژن مقداری الکترون به دست آورده است) علت احیا اکسیداسیون است.
حالت اکسیداسیون چیست؟
حالت اکسیداسیون که به آن مقدار اکسیداسیون نیز گفته می شود، درجه اکسیداسیون (از دست دادن الکترون) یک اتم را در یک ترکیب شیمیایی تعریف می کند. آنتوان لاووازیه برای اولین بار از اصطلاح اکسیداسیون برای توصیف واکنش یک ماده با اکسیژن استفاده کرد.
نمونه ای از اکسیداسیون آهسته چیست؟
زنگ زدگی آهن و پوسیدگی چوب نمونه های خوبی از اکسیداسیون تدریجی هستند.
منظور از واکنش اکسیداسیون – احیا چیست؟
واکنش شیمیایی که در آن عدد اکسیداسیون یک اتم، یون یا مولکول با از دست دادن یا به دست آوردن یک الکترون تغییر می کند، واکنش اکسیداسیون- احیا نامیده می شود.
تفاوت عمده بین اکسیداسیون و احیا چیست؟
احیا به دست آوردن الکترون است در حالی که اکسیداسیون از دست دادن الکترون است.


آقای نیک نام زندگیمو مدیون شمام
مرسی
محتوا خوبی بود
من یکی از کاربران دائمی سایت شما هستم
مثل همیشه عالی و کاربردی
خیلی دنبال این موضوع بودم
نویسنده این متن کیه؟
هزینه مشاورتون چنده؟
چه مطلب خوبی
مشاوره آنلاین هم دارید
دفتر مرکزیتون کجا قرار داره