مقدمه
کمیت دقیق پروتئین برای مطالعات پروتئین در بسیاری از مباحث تحقیق ضروری است. طیف گسترده ای از روشهای مختلف برای تعیین کمیت در مخلوط پیچیده دو پروتئین و همچنین یک نوع پروتئین واحد وجود دارد.
بعد از تمام کردن این محتوا درباره استخراج پروتئین نیز مطالعه بفرماید.
روشهای سنجش پروتئین شامل روشهای سنتی مانند اندازه گیری میزان جذب اشعه ماوراء بنفش در 280 نانومتر ، سنجش اسید بیکین کوننیک (BCA) و برادفورد ، و همچنین روشهای جایگزین مانند Lowry یا سنجشهای جدید تولید شده توسط تأمین کنندگان تجاری وکیت مناسب برای هر نوع سنجش است که غالباً نتیجه خوبی را ارائه می دهند.
روش های سنجش کمی پروتئین شامل روش ایمنی تحریک کننده ایمنی وابسته به آنزیم (ELISA) ، تجزیه و تحلیل وسترن بلات ، و اخیراً ، طیف سنجی جرمی ، از جمله روش های دیگر است. در موارد خاص مقررات یا قوانین گروه تجارت ممکن است به روشهای خاصی برای تعیین کمیت پروتئین نیاز داشته باشد. به عنوان مثال ، انجمن بین المللی صنعت سرم http://www.serumindustry.org ، یک گروه تجاری برای ارائه دهندگان سرم ، روش Biuret را برای تعیین محتوای پروتئین در محصولات سرم توصیه می کند.
در اینجا ما در مورد برخی از روشهای رایج مورد استفاده برای تعیین غلظت پروتئین در محلول ، مزایا و محدودیت های آنها صحبت می کنیم. توجه به این نکته مهم است که هیچ یک از این روشهای پروتئینی مختص پروتئین نیستند ، به این معنی که اجزایی غیر پروتئین ممکن است تداخل داشته باشند ، یا یکنواخت و سازگار با کلیه پروتئین ها باشند. علاوه بر این ، اصلاح پروتئین می تواند در تخمین غلظت پروتئین برای برخی از سنجش ها در مقایسه با پروتئین اصلاح نشده تاثیرگذار باشد . بعلاوه برخی از سنجشها ، به عنوان مثال روش 3- (4-کربوکسی بنزوئیل) کینولین-2-کربوکسالدئید (CBQCA) همچنین در تعیین کمیت پپتیدها یا پروتئینهای متصل به سطح یا محصور شده مؤثر هستند.
شما میتوانید برای دریافت مواد مورد نیاز برای تحقیقات خود و فروش مواد شیمیایی موجود خود با ما در ارتباط باشید.
سنجش کمی پروتئین
جدول 1 سنجش کمی پروتئین کل را خلاصه می کند. موارد کمتر رایج مانند پیرس 660 از ترمو ، کمی سازی پروتئین NanoOrange ، فلورومتر Qubit ، مورد بحث قرار نمی گیرد. ارزیابی سازگاری هر روش با انواع نمونه ، دامنه سنجش ، حجم نمونه و در دسترس بودن یک اسپکتروفتومتر مناسب و همچنین زمان و هزینه بسیار مهم است.
| سنجش | جذب | مکانیزم | حدود تشخیص | مزایا | معایب |
| جذب اشعه فرابنفش (UV) | 280 nm | جذب تیروزین و تریپتوفان | 0.1-100 ug/ml | حجم نمونه کوچک ، سریع ، کم هزینه | ناسازگار با مواد شوینده و مواد دفع کننده ، تنوع بالا |
| Bicinchoninic اسید | 562 nm | کاهش مس(Cu2+ to Cu1+), واکنشBCA با Cu1+ | 20-2000 ug/ml | سازگار با مواد شوینده و مواد دفع کننده ، تنوع کم | سازگاری کم یا عدم سازگاری با عوامل کاهش دهنده |
| برادفورد یاCoomassie brilliant blue | 470 nm | تشکیل پیچیده بین رنگ آبی درخشان Coomassie و پروتئین ها | 20-2000 ug/ml | سازگار با عوامل کاهش دهنده ، سریع | با مواد شوینده ناسازگار است |
| Lowry | 750 nm | کاهش مس توسط پروتئین ها ، کاهش فولین-سیوکالتو توسط مجموعه پروتئین مس – پروتئین | 10-1000 ug/ml | حساسیت و دقت بالا | ناسازگار با مواد شوینده و مواد کاهنده ، روش زمانبر |
جدول 1. روش های رایج سنجش کمی پروتئین
جذب اشعه فرابنفش (UV) در 280 نانومتر (دامنه: ug / ml 0.1 -100)
آمینو اسیدهای آروماتیک تیروزین و تریپتوفان مشخصه خود ( جذب ماوراء بنفش (UV) در 280 نانومتر) به پروتئین می دهد ، که به طور معمول برای تخمین غلظت پروتئین مورد استفاده قرار می گیرد.
پیوندهای فنیل آلانین و دی سولفید نیز در جذب با سرعت 280 نانومتر ، هرچند اندک ، نقش دارند. این روش ساده است ، و می تواند با حجم نمونه بسیار اندک ، به اندازه حداقل ul 0.5 انجام شود ، زیرا اسپکتروفتومترهای جدید در طول اندازه گیری از سیستم نگهدارنده نمونه استفاده می کنند. با این حال ، نمونه پروتئین نباید حاوی اجزای غیر پروتئینی با جذب قابل توجهی در 280 نانومتر باشد ، مانند آلاینده های اسیدهای نوکلئیک.
برای نمونه های پروتئین خالص ، باید توالی اسید آمینه دقیقی از پروتئین آنالیز شده شناخته شود و قبل از تعیین غلظت محلول ، باید ضریب جذب خاص برای پروتئین خاص محاسبه شود. این روش سریع است ، اما دارای خطا است و با طیف گسترده ای از روشهای استخراج پروتئین که اغلب از مواد شوینده و مواد دفع کننده بدن استفاده می کنند ناسازگار است.
bicinchoninic اسید (BCA) یا روش مبتنی بر مس (دامنه : ug / ml 20-2000 )
سنجش اسید bicinchoninic (BCA) در سال 1985 توسط پل اسمیت در شرکت پیرس شیمیایی ، توزیع کننده اصلی این سنجش اختراع شد . هر دو روش BCA و Lowry مبتنی بر تبدیل Cu2+ به Cu1+ در شرایط قلیایی است. این تبدیل به واکنش Biuret (شکل 1) گفته می شود و تحت تأثیر چندین باقیمانده اسید آمینه (سیستئین ، سیستین ، تیروزین و تریپتوفان) و ستون فقرات پپتید قرار دارد.
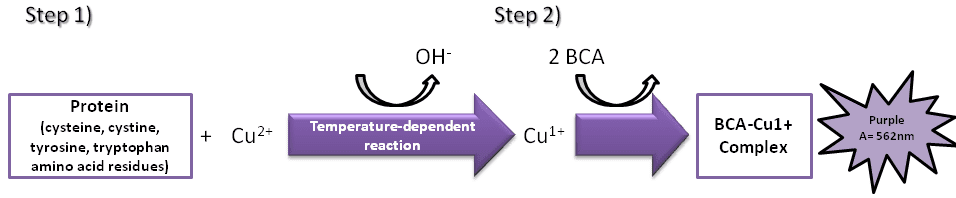
شکل 1. نمایش شماتیک روش BCA.
مکانیزم روش BCA
BCA یک معرف خاص کروموژنیک برای Cu1+ است و در مرحله دوم واکنش دو مولکول BCA با یک یون مس +1 واکنش می دهند. مقدار Cu2+ کاهش یافته تابعی از غلظت پروتئین است که با تغییر رنگ محلول نمونه از آبی به بنفش ، که در 562 نانومتر نوری جذب می کند ، می تواند به صورت اسپکتروفتومتری تعیین شود.
میزان جذب مستقیماً با مقدار پروتئین موجود در محلول متناسب است و می توان آن را با مقایسه با یک استاندارد پروتئین شناخته شده مانند آلبومین سرم گاوی (BSA) تخمین زد. از آنجا که BSA و پروتئین / پپتید اندازه گیری شده ممکن است دارای توسعه کرومورفریک متفاوت باشند ، مقدار پروتئین / پپتید باید تنظیم شود. به عنوان مثال ، نورتلی آر و همکاران میزان غلظت اندازه گیری پپتیدهای آمیلوئید بتا را با کیت سنجش پروتئین پیرس BCA و BSA به عنوان استاندارد با ضریب 1.51 ضرب کردند.
تداخل ها و سازگاری در روش BCA
آزمایش BCA به طور کلی تحمل مواد شوینده یونی و غیر یونی مانند NP-40 ، Triton X-100 و مواد دفع کننده مانند اوره و کلرید گوانیدینیوم که تمایل به ایجاد اختلال در سایر سنجش های پروتئین رنگی مانندLowry (جدول 2) دارند را دارد. با این حال ، برخی از معرفها ، مانند اسید اتیلن دی آمینتراستتیک (EDTA) ، با کاهش قندها و لیپیدها، می توانند در آزمایش BCA اختلال ایجاد کنند.
اثرات چنین تداخلاتی را می توان با راهکارهایی مانند کاهش مواد مداخله کننده از طریق دیالیز ، فیلتراسیون ژل یا اگر غلظت پروتئین به اندازه کافی بالا باشد ، با رقیق کردن نمونه، از بین برد. ریچلت و همكاران تعدیل ساده ای را برای روشی ارائه كردند كه می تواند منجر به بهبود قابل مشاهده در دقت اندازه گیری شود ، به خصوص برای پروتئین غیر تصفیه شده در محلولهای پیچیده مانند محیط كشت.
آنها با استفاده از سنبله داخلی پروتئین BSA که به هر نمونه اضافه می شود ، از یک فاکتور تصحیح استفاده می کنند. بر اساس مطالعات آنها ، میزان کمی پروتئین BCA را می توان پنج برابر بهبود بخشید ، و دقت کمی سنجی BCA را با رویکردهای گرانتر قابل مقایسه می کند .
پیشنهاد میکنم حتما با بقیه اسید ها نیز آشنا بشوید.
یکی دیگر از عواملی که با دقت آزمایش BCA تداخل دارد ، وجود باقیمانده های شیمیایی اصلاح شده در پروتئین است. بردی و مکنوتان تأثیر متیلاسیون لیزیل را در روشهای برادفورد و BCA ارزیابی کردند و دریافتند که برای سنجش BCA ، غلظت پروتئین در نمونه های پروتئین متیله شده به طور مداوم بیش از حد تخمین زده می شود.
Thermo Fisher Pierce نسخه جدیدی از روش پروتئین BCA به نام Pierce ™ BCA Protein Assay Assay – Reducing Agent Compatible را دارد که باعث تحمل دیتیوتیریتول (DTT) ، 2-مرکاپتواتانول (BME) ، TCEP و سایر عوامل کاهش دهنده دی سولفید می شود.
| NP-40 | Sucrose |
| Emulgen | Glycine, pH 2.8 |
| HEPES | Glucose |
| DTT | EDTA |
| Triton X-100 | NaCl |
| Urea | NaOH |
| Guanidine HCl | Ammonium Sulfate |
| Sodium Acetate, pH 5.5 | SDS |
جدول 2. سازگاری با روش سنجش پروتئین BCA .
توجه: غلظت بالایی از معرفهای ذکر شده روی آزمایش BCA تأثیر می گذارد. برای محدودیت غلظت هر ماده شیمیایی با راهنمای تولید کننده مشورت کنید.
مزایای روش BCA
روش BCA مزایای زیادی دارد. در مقایسه با روش های دیگر ، آزمایش BCA یکی از حساس ترین است (می تواند پروتئین ها را در غلظت های کم ug/mL 5 تشخیص دهد). این تنوع کمتر از سایرین (به عنوان مثال ، آزمایش بردفورد) است و می توان از آن برای اندازه گیری طیف گسترده ای از غلظت پروتئین استفاده کرد.
علاوه بر این ، حساسیت آن را می توان با انجام سنجش در حضور نانو حسگرهای پلاسمونی همانطور که در روش SPR-BCA (سطح پلاسمون رزونانس – BCA) ارائه شده توسط لیو و همکاران افزایش یافته است . با این روش حد تشخیص 3/4 نانوگرم در میلی لیتر و محدوده کاری عمومی 5/0 تا 1000 میکروگرم بر میلی لیتر بود ، بنابراین غلظت پروتئین را که می توان با روش سنتی BCA اندازه گیری کرد پایین آورد.
سنجش پروتئین Bradford یا Coomassie brilliant blue (دامنه: ug / ml 20-2000 )
روش برادفورد ، که ابتدا توسط دکتر ماریون بردفورد در سال 1976 توصیف شد ، یک روش محبوب برای تعیین غلظت پروتئین است. این ماده به تشکیل مجتمع بین رنگ Coomassie درخشان آبی G-250 و پروتئین های موجود در محلول متکی است. معرف برادفورد در چهار شکل مختلف یونی وجود دارد.
سنجش پروتئین لوری
(دامنه : ug / ml10 -1000)
روش لوری ، که توسط Oliver H. Lowry در سال 1951 پیشنهاد شد ، براساس دو واکنش شیمیایی است (شکل 2). اولین واکنش کاهش یون های مس در شرایط قلیایی است که یک مجموعه با پیوندهای پپتید را تشکیل می دهد (واکنش Biuret که در بالا مورد بحث قرار گرفت). مورد دوم ، كاهش معرف Folin-Ciocalteu توسط مجموعه پيوند مس – پپتيد است كه متعاقباً با جذب در محدوده 650 تا 750 نانومتر قابل تشخيص با يك اسپكتروفتومتر مي تواند باعث تغيير رنگ محلول در آب شود. میزان پروتئین موجود در نمونه را می توان با استفاده از یک منحنی استاندارد از یک محلول استاندارد پروتئین انتخابی مانند BSA تخمین زد.
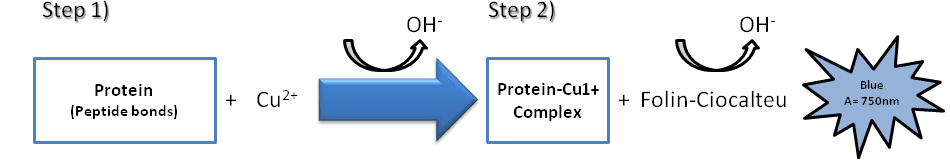
شکل 2. نمایش شماتیک روش لوری
از مزایای این سنجش حساسیت آن و از همه مهمتر دقت آن است. با این وجود ، زمان بیشتری نسبت به سنجش های دیگر نیاز دارد و بسیاری از ترکیبات که معمولاً در بافرها برای تهیه پروتئین مورد استفاده قرار می گیرند (مانند مواد شوینده ، کربوهیدرات ها ، گلیسرول ، تریسین ، EDTA ، تریس) در سنجش لوری دخالت می کنند و رسوبات را تشکیل می دهند (جدول 3) . با این وجود ، با رقیق کردن نمونه می توان اثر این مواد را کاهش داد ، اما تنها در صورتی که غلظت پروتئین به اندازه کافی زیاد باشد. علاوه بر این ، نشان داده شده است که می توان زمان انجام این سنجش را از طریق بالا بردن درجه حرارت یا استفاده از اجاق مایکروویو کاهش داد.
| Detergents | Disulfide compound |
| Carbohydrates | Phenol |
| Glycerol | Uric acid |
| Tricine | Guanine |
| EDTA | Xanthine |
| Tris | Magnesium Calcium |
| Potassium compounds | Sulfhydryl compounds |
جدول 3. سنجش پروتئین لوری، مواد تداخل کننده.
روش 3- (4-کربوکسی بنزوئیل) کینولین-2-کربوکسالدهید (CBQCA) (دامنه 100 نانوگرم-1500 میکروگرم بر میلی لیتر)
3- (4-کربوکسی بنزوئیل) کینولین-2-کربوکسالدهید (CBQCA) یک معرف حساس فلوروژن است که برای تشخیص آمین ها در پروتئین ها استفاده می شود. از آنجا که در پروتئین مورد سنجش فقط می تواند آمین های قابل دستیابی را تشخیص دهد ، این روش دارای همان محدودیت در روش های اسپکتروفتومتری است که نتیجه آن به تعداد اسیدهای آمینه خاص در پروتئین بستگی دارد.
با این حال ، CBQCA بسیار حساس است و می تواند از 10 نانوگرم تا 150 اونگ پروتئین را در حجم 100 ul تشخیص دهد. همچنین از طرف مثبت ، معرف CBQCA در حضور موادی مانند لیپیدها به خوبی عمل می کند ، که در بسیاری از روش های تعیین پروتئین دیگر دخالت دارد ، یا هنگامی که برای تعیین کمیت پپتیدها یا پروتئین های متصل به سطح یا کپسوله شده استفاده می شود.
سنجش کمی یک پروتئین خاص
یک مرحله مهم در بسیاری از آزمایشگاههای بیولوژیکی تعیین کمیت یک پروتئین خاص در محلول است. چندین روش برای تحقق آن استفاده شده است. روشهای رایج این روشهای سنجش ELISA ، آنالیز وسترن بلات و طیف سنجی جرمی است. ELISA و وسترن بلات در برنامه های کاربردی آنتی بادی مورد بحث قرار گرفته است ، مشخصات جمعی در اینجا مختصراً مورد بحث قرار می گیرد و در مقاله مروری Labome بررسی بیوآنالیز کمی پروتئین ها توسط طیف سنجی جرمی مورد بحث قرار می گیرد.
طیف سنجی جرمی پروتئین
طیف سنجی جرمی پروتئین یک روش نسبتاً جدید و در حال توسعه برای تعیین کمیت پروتئین است. علاوه بر خصوصیات پروتئین ، یک مرحله مهم در تجزیه و تحلیل پروتئومیک امکان کمی سازی پروتئین خاص است. روش های بسیاری برای سنجش پروتئین توسط طیف سنجی جرمی معرفی و اجرا شده است.
هنگامی که برچسب زدن پروتئین امکان پذیر باشد ، یک پروتئین یا نمونه پپتیدی با ایزوتوپ سنگین پایدار (به عنوان مثال ، 13C یا 15N برچسب گذاری می شود در حالی که نمونه دوم (استاندارد داخلی) با ایزوتوپ سبک تر نشان داده می شود (مثلاً 12C یا 14N). نمونه ها با هم مخلوط شده و اختلافات جرم به دلیل برچسب ها امکان تجزیه و تحلیل نسبت دو شدت اوج نمونه توسط یک آنالیزور جرم را فراهم می کند ، که با نسبت فراوانی نسبی آنها مطابقت دارد. روش های جایگزین اجازه می دهد تا اندازه گیری پروتئین توسط طیف سنجی جرمی بدون برچسب زدن نمونه ها انجام شود .
دستورالعمل برای اندازه گیری طیف سنجی جرمی هدفمند از پپتیدها و پروتئین ها منتشر شده است تا سعی شود از روش های دقیق و قابل مقایسه در این روش به سرعت در حال توسعه استفاده شود. با این حال ، این روش به ابزارآلات گران قیمت نیاز دارد که بسیاری از آزمایشگاه ها قادر به تهیه آن نیستند و این باعث می شود که ابزار این روش محدود شود .
برای سنجش سنجش طیف سنجی جرمی پروتئین ها ، استانداردهای پپتید داخلی برای چندین پروتئین را می توان به منظور جمع آوری پروتکل پروتئین ها (پروتئین QCAT) با هم جمع کرد. پسوندی از این روش توسعه داده شده است كه در آن این پپتیدهای توأم شده شامل اپی توپ های آنتی ژن برای آنتی بادی های متعدد هستند. پروتئین های کالیبراسیون متصل به اصطلاح DOSCAT (کانسیلرهای دو استاندارد) می توانند نیازهای طیف سنجی جرمی و وسترن بلات را تأمین کنند.
کمیت پروتئین در سلولهای زنده تک
بیان پروتئین را می توان با اتصال ژنتیکی پروتئین مورد علاقه به پروتئین یا اپی توپ مانند پروتئین فلورسنت سبز (GFP) در سلولهای زنده کنترل کرد. پیوند پروتئین مورد علاقه به خبرنگار با یک عنصر خاص هیدرولاز مؤثر سیس موسوم به “گزارشگر کمیت پروتئین” (PQR) اجازه می دهد تا پروتئین و گزارشگر با هم رونویسی شوند اما به عنوان پروتئین های عملکردی جداگانه ترجمه می شوند. این می تواند بیان استوکیومتری پروتئین و گزارشگر را تضمین کند. بنابراین ، مقدار پروتئین را می توان از شدت فلورسنت استنباط کرد .
نانوذرات و روشهای مبتنی بر نانوذرات
محدودیتهای روشهای کمی که در بالا مورد بحث قرار گرفته است منجر به تدوین استراتژیهای جدید برای تعیین غلظت پروتئین در محلولهای ساده و پیچیده شده است. یکی از محبوب ترین ها از خواص نوری نانوذرات بهره می برد . به طور خلاصه ، طول موجی که نانوذرات خاص در آن به دلیل اتصال سایر مولکولها یا به تجمع تبدیل می شوند ، نور را جذب می کنند .
از آنجا که محدوده جذب نور در طیف قابل مشاهده است ، این تغییر به عنوان تغییر رنگ درک می شود. نانوذرات تاکنون در ارتباط با ذرات پروتئین کننده ، به عنوان مثال آنتی بادی ، پپتید یا آپتامر مورد استفاده قرار گرفته اند. روگوفسكی و همكاران نوع جدیدی از حسگر نانوذرات را برای تشخیص و تعیین پروتئین ها پیشنهاد كردند ، كه آنها را “بینی شیمیایی” می نامیدند.
سنسور آنها از ترکیبی از نانوذرات طلا با اشکال مختلف تشکیل شده است که هنگام تعامل با پروتئین های مختلف ، تجمع دیفرانسیل را نشان می دهند . بر اساس طیف جذب نور آنها ، این ذرات امکان شناسایی و کمیابی پروتئین های خالص در محلول های آبی یا پروتئین های غیر تصفیه شده در محلول های پیچیده را فراهم می کنند.
كونگ و همكاران برای اندازه گیری غلظت پروتئین ها در محلول در محدوده نانومولار ، روشهایی را با استفاده از مولكول های حامل DNA طولانی و نانوذرات شیشه ای جامد توسعه دادند .
در این روش ، مولکول های حامل DNA قادر به اتصال پروتئین ها در مکان های خاص هستند و به کمک یک جریان الکتریکی از طریق نانوذرات انتقال می یابند. هنگام انتقال ، DNA باعث ایجاد سیگنال افت جریان می شود. هنگامی که یک پروتئین به DNA وصل می شود ، افت اضافی ثبت می شود. غلظت پروتئین هر چه بالاتر باشد حامل “بارگیری” بیشتری می کند. فراوانی قله های افت جریان ثانویه نیز با افزایش غلظت پروتئین افزایش می یابد (شکل3).
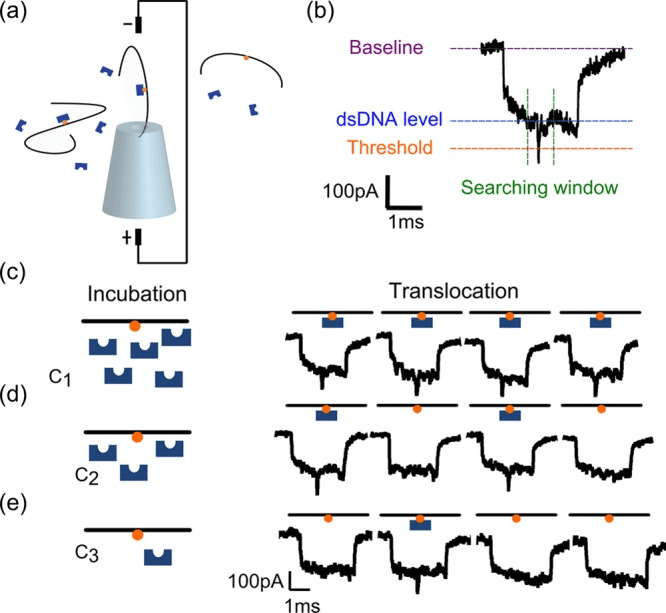
شکل 6. نمودار شماتیک از مولکولهای حامل DNA که از طریق یک نانوذرات جابجا می شوند (a) اوج افت فعلی ناشی از انتقال DNA و افت ثانویه که نشانگر DNA “بارگذاری شده” است (b). حوادث انتقال DNA در کاهش غلظت پروتئین (C ، D و E).
سوالات رایج
برای استاندارد پروتئین چه می توانم استفاده کنم؟
بهترین استاندارد برای تعیین کمیت پروتئین همان پروتئینی است که مورد بررسی قرار می گیرد. با این حال ، این معمولاً عملی نیست. BSA (آلبومین سرم گاوی) متداول ترین استاندارد پروتئین است. با این حال محدودیت هایی دارد.
در روش برادفورد نسبت به پروتئین های دیگر حساس تر است ، بنابراین غلظت نمونه پروتئین احتمالاً دست کم گرفته می شود. علاوه بر این ، BSA ، به عنوان یک پروتئین سرم ، نمی تواند با خلوص بسیار بالا تهیه و به دست آید ، زیرا به بسیاری از عوامل دیگر پیوند می زند.
پروتئین های دیگر مانند ایمونوگلوبولین G و لیزوزیم به عنوان استاندارد پروتئین نیز استفاده شده اند. بهترین گزینه در یک آزمایش خاص بسته به پروتئین (بازدید کنندگان) مورد علاقه شما و روش کمی که شما انتخاب می کنید متفاوت است.
نقطه داده نمونه من خارج از محدوده منحنی استاندارد است ، آیا می توان منحنی استاندارد را برون داد؟
خیر بسیار مهم است که نقاط داده نمونه در محدوده منحنی استاندارد قرار گیرند زیرا منحنی ممکن است در غلظت های بالاتر یا پایین تر به طور غیرقابل پیش بینی متفاوت باشد. رقت نمونه ها و / یا استانداردهای شما باید تنظیم شود تا نمونه های شما در منحنی استاندارد نگه داشته شود.
مطالعه ی بیشتر
برای مطالعه ی بیشتر و بررسی دقیق روش های نام برده می توانید از پی دی اف زیر استفاده کنید.
منابع
https://www.labome.com/method/Protein-Quantitation.html
http://wolfson.huji.ac.il/purification/PDF/Protein_Quantification/PIERCE_ProteinAssayHandbook.pdf


احسنت عالی بود
خیلی عالی بود
مرسی
کانال تلگرامی هم دارید ؟
واقعا لقب امپراطور رابطه لقب شماست
خیلی ممنون از توضیحاتون خوبتون
مطلب خوبی بود
متشکرم
مشاوره برای رابطه هم دارید؟
شما همیشه امیدوارم کننده صحبت می کنید و این خیلی خوبه
هزینه رپورتاژ آگهی توی سایت شما چنده؟